طول رابطة O-H فى حالة حمض الأستيك أطول منها فى حالة الكحول الإيثيلي
وذلك بسبب وجود مجموعة الكربونيل الساحبة للألكترونات فى حالة حمض الأستيك حيث تتكون شحنة موجبة على ذرة الأكسجين فى مجموعة الهيدروكسيل وتحاول هذة الذرة تعويض الألكترونات المسحوبة منها فتجذب ألكترونات الرابطة OH نحوها مما يؤدى إلى تطويل الرابطة OH فى حالة حمض الأستيك.
وهذا يعرف بالرنين Resonance
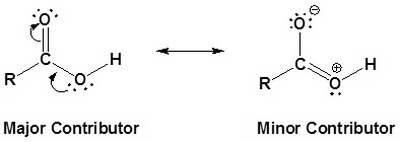
على عكس وجود المجموعات المعطية للألكترونات فى حالة الكحول الإيثيلي.
وهذا يفسر أن حمضية الأحماض الكربوكسيلية أكثر بكثير من حمضية الكحولات المناظرة لها لأنه كما كانت الرابطة أطول كلما كانت أضعف كلما سهل فقدها فتزداد الحامضية.