تدرج السالبية الكهربية فى الجدول الدورى
فى الدورات الأفقية
تزداد السالبية الكهربية إذا اتجهنا من اليسار إلى اليمين أى بزيادة العدد الذرى ونقص نصف القطر وهذا يؤدى إلى زيادة قوة جذب النواة لإلكترونات الرابطة.
فى المجموعات الرأسية
تقل السالبية الكهربية من أعلى إلى أسفل أى بزيادة العدد الذرى وزيادة نصف القطر وهذا يؤدى إلى نقص قوة جذب النواة لإلكترونات الرابطة.
قيم الكهروسالبية Electronegativity
- يوضح الجدول الدورى التالى قيم الكهروسالبية للعناصر
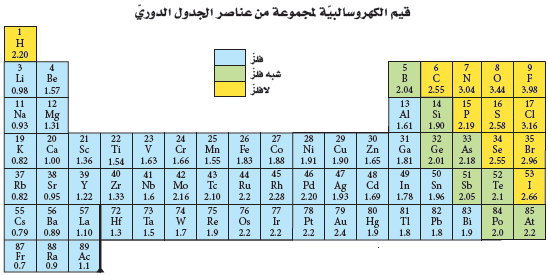
- تحسب قيم الكهروسالبية بمقارنة قوة جذب الذرة للإلكترونات المشتركة إلى قوة جذب ذرة الفلور لهذة الإلكترونات.
لاحظ أن مقادير الكهروسالبية لسلسلتي اللانثانيدات والأكتينيدات غير ظاهرة في الجدول لكنها تتراوح ما بين 1.12 - 1.7
- لاحظ أن للفلور (F) أعلى قيمة للكهروسالبية 3.98 في حين أن للفرانسيوم أقل قيمة 0.7
- ولأن الغازات النبيلة لا تتفاعل في الغالب، ولا تميل إلى تكوين مركبات -إلا في حالات نادرة- لذا لا يتضمن الجدول قيم الكهروسالبية للهيليوم والنيون والأرجون. ومع ذلك تتحد الغازات النبيلة الكبيرة -ومنها الزينون- مع الذرات التي لها قيم كهروسالبية عالية مثل الفلور.
- يمكنك مراجعة هذا الموضوع : كيف تم حساب أرقام السالبية الكهربية في مقياس باولينج؟
رتب العناصر الآتية تصاعدياً حسب السالبية الكهربائية: N / H / Na / O / S؟
نكتب التوزيع الألكتروني للعناصرونحدد الدورات والمجموعات لكل عنصر:
H1 : 1s1 المجموعة 1A والدورة الأولي
N7 : 1s2 , 2s2 2p3 المجموعة 5A والدورة الثانية
O8 : 1s2 , 2s2 2p4 المجموعة 6A والدورة الثانية
Na11 : 1s2 , 2s2 2p6 , 3s1 المجموعة 1A والدورة الثالثة
S16 : 1s2 , 2s2 2p6 , 3s2 3p4 المجموعة 6A والدورة الثالثة
(1) النيتروجين والأكسجين يقعان فى نفس الدورة الثالثة وفى الدورات تزداد السالبية الكهربية بزيادة العدد الذري لذلك يكون الأكسجين أكبر سالبية كهربية من النيتروجين
O > N
(2) الصوديوم والكبريت يقعان فى نفس الدورة الثانية وفى الدورات تزداد السالبية الكهربية بزيادة العدد الذري لذلك يكون الكبريت أكبر سالبية كهربية من الصوديوم.
S > Na
(3) الصوديوم والهيدروجين يقعان فى نفس المجموعة وفى المجموعات تزداد السالبية الكهربية بنقص العدد الذري لذلك يكون الهيدروجين أكبر سالبية كهربية من الصوديوم.
H > Na
(4) الأكسجين والكبريت يقعان فى نفس المجموعة وفى المجموعات تزداد السالبية الكهربية بنقص العدد الذري لذلك يكون الأكسجين أكبر سالبية كهربية من الكبريت.
O > S
(5) الكبريت والنيتروجين يقعان فى مجموعات مختلفة ودورات مختلفة لكن نظراً لاقتراب التوزيع الألكتروني للنيتروجين من التوزيع الألكترونى للأكسجين ذو السالبية العالية والأعلى من الكبريت لذلك فأن النيتروجين أعلى سالبية كهربية من الكبريت
N > S
من العلاقات (1) , (2) , (3) , (4) , (5) نجد أن:
O > N > S > H > Na