أولاً/ حساب تركيز أيون الهيدروجين
بما أن هناك ثابت تأين للحمض فأن حمض ضعيف ويتاين تأين جزئي ويكون:
-HA ↔ H+ + A
وتكون التركيزات عند الأتزان كالتالي:
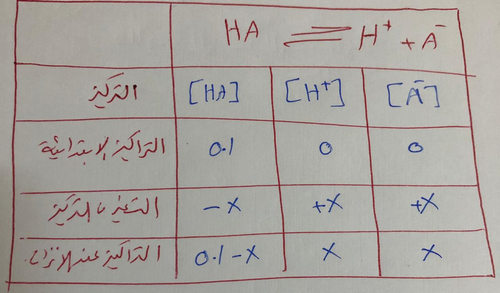
وبتطبيق قانون الإتزان
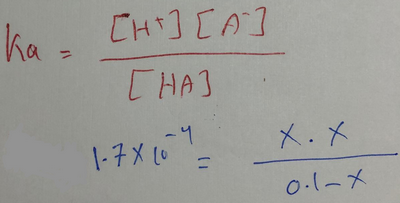
قيمة Ka للحمض ضعيفة وبالتالي يكون مقدار ما يتفكك من الحمض (X) صغيرة جداُ يمقارنة بالتركيز الأبتدائي لذلك يكون :
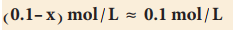
وبالتعويض فى القانون السابق:
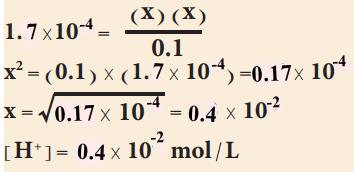
(2) حساب الرقم الهيدروجيني pH
[+pH = -log [H
(pH = -log (0.4 x 10-2
pH = 2.4
(3) حساب الرقم الهيدروكسيدي pOH
pH + pOH = 14
pOH = 14 - 2.4
pOH = 11.6