المواد المحددة للتفاعل والمواد الفائضة
- المادة المحددة للتفاعل هي المادة التي تستهلك كليًا في التفاعل وتحدد كمية المادة الناتجة.
- لذلك تبقى كميات من المواد المتفاعلة الأخرى بعد توقف التفاعل بدون استهلاك. وتسمى هذة المواد المتبقية المواد الفائضة.
- ولمساعدتك على فهم المواد المحددة للتفاعل والفائضة يمكننا بناءً على المواد المتوافرة تكوين أربع مجموعات تتألف من كماشة ومطرقة ومفكين. وقد حُدّد عدد المجموعات بناءً على عدد المطارق، لذا تبقى الكماشات والمفكات فائضة.

المعلوم والمطلوب
المعلوم: حجم غاز النيتروجين = 44.8L ، حجم غاز الأكسجين = 144L
المطلوب: حجم المادة الفائضة من الهيدروجين = ؟
أولاً/ تحديد المادة المحددة للتفاعل والمادة الفائضة
(1) نكتب المعادلة الموزونة ونحدد المعطيات والمطلوب:
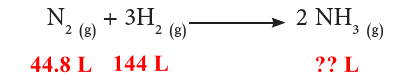
(2) نحسب عدد مولات المواد المتفاعلة
من القانون التالي :
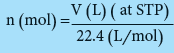
(أ) حساب عدد مولات N2
nN2 = 44.8/22.4 = 2 mol
(ب) نحسب عدد مولات H2
nH2 = 144/22.4 = 6.43 mol
(3) احسب النسب المولية الفعلية لمولات H2 , N2
- احسب نسبة مولات H2 إلى N2
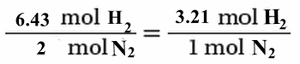
(4) حدد النسبة المولية للمواد المتفاعلة من المعادلة الموزونة:

وبما أنه يتوافر 3.21mol من الهيدروجين ، في حين أن التفاعل يحتاج فقط 3mol من الهيدروجين لتتفاعل مع 1mol من النيتروجين لتكوين 1mol من NH3 فالهيدروجين هو المادة الفائضة ويكون النيتروجين N2 هو المادة المحددة للتفاعل.
ثانياً/ حساب كتلة المادة الفائضة
- بما أن H2 هو المادة الفائضة فإن جزءاً منه فقط يتفاعل. لذا استخدام المادة المحددة للتفاعل N2 لحساب عدد مولات H2 الداخل في التفاعل وكتلته.
1mol N2 → 3 mol H2
2mol N2 → ?? mol H2
nH2 = 6 mol
تحويل مولات الأكسجين الداخلة فى التفاعل إلى حجم باللتر من القانون التالي:
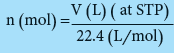
VH2 = 6 * 22.4 = 134.4L
حساب كمية H2 الفائضة
الكمية الفائضة = الحجم الكلي للهيدروجين - حجم الهيدروجين التى تفاعلت
144L H2 - 134.4 H2 = 9.6L H2