المعامل الوزني Gravimetric Factor
- يرمز له بالرمز Gf
- هو النسبة بين الكتلة المولية للمكون المراد تقديره إلى الكتلة المولية للصيغة الوزنية (الراسب) على شـرط أن تحتوي كلتا الصيغتين على نفــس العدد من ذرات العنصر (أو جزيئات المكون) المـراد تقديره.
- ويمكن التعبير عن المعامل الوزني بشكل عام بالعلاقة الاتية:

- حيث أن a , b تمثلان أصغر الاعداد التي لها قيم مناسبة لجعل الصيغتين الكيميائيتين في البسط والمقام تحويان على نفس العدد من المكون المراد تقديره.
- الجدول التالي يوضح أمثلة المعامل الوزني:
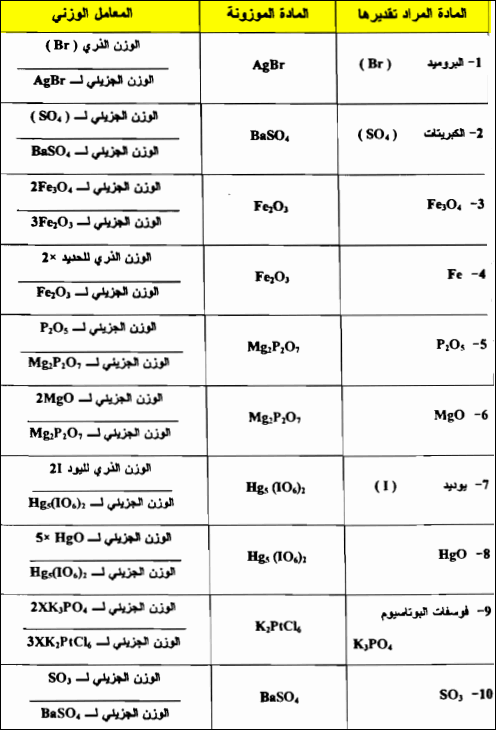
أهمية حساب المعامل الوزني
- ويستفاد من قيمة المعامل الوزني بعد حسابه بشكل صحيح في ايجاد كتلة المكون المراد تقديره بدلالة كتلة الراسب الذي تم الحصول عليه عملياً وذلك بضرب قيمته في كتلة الراسب (الصيغة الوزنية) كما هو مبين في العلاقة الاتية:
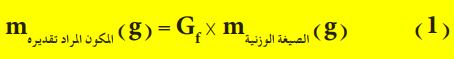
أو يستفاد منه لحساب النسبة المئوية للمكون المراد تقديره في العينة باستعمال العلاقة الاتية

وبتعويض المكون المراد تقديرهm من المعادلة (1) في المعادلة (2) نحصل على:
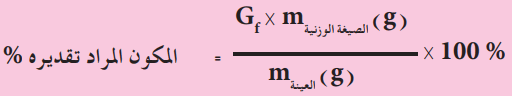
اذيبت كمية مجهولة من كبريتات المغنسيوم المائية MgSO4.7H2O ، ثم رسبت على شكل فوسفات المغنسيوم الامونياكي (MgNH4PO4) ثم عومل الراسب واحرق ووزن على هيئة بيرفوسفات المغنسيوم (Mg2P2O7) بوزن قدره 0.3545 جم ، احسب وزن كبريتات المغنسيوم المائية؟
الحل:
أولاً/ حساب المعامل الوزني
من القانون التالي :

- المكون المراد تقديره هو MgSO4.7H2O
- الراسب المتكون = الصيغة الوزنية هو Mg2P2O7
- وبما أن عدد ذرات الماغنسيوم مختلفة فأن a = 2 ، b = 1 حتى تكون عدد ذرات الماغنسيوم متساوية فى البسط والمقام.
- الكتلة المولية MgSO4.7H2O لكبريتات الماغنسيوم المائية = 246.5 جم/مول.
- الكتلة المولية للصيغة الوزنية Mg2P2O7 بيرفوسفات المغنسيوم = 222.6 جم/مول
وبالتعويض فى القانون السابق نجد أن:
Gf = 2*246.5 / 1*222.6
Gf = 2.21
ثانياً/ حساب كمية كبريتات الماغنسيوم المائية
ومن العلاقة التالية يمكن حساب كمية كبريتات الماغنسيوم المائية
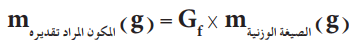
كتلة الراسب (بيرفوسفات الماغنسيوم ) = 0.3545 جم
المعامل الوزني = 2.21
بالتعويض فى القانون نجد أن:
mMgSO4.7H2O = 2.21 *0.3545
mMgSO4.7H2O = 0.785g
ملحوظة هامة : الحل الرياضي للمسألة مجهود شخصى وليس له أى مرجع أو مصدر وعلى ذلك فأنه قد يحتمل الصواب والخطأ.