الأدلة فى المعايرة Indicators
- المعايرة هي عملية كيميائية مخبرية يتم من خلالها معرفة حجم المحلول القياسي (حمض أو قاعدة) اللازم ليتفاعل مع المحلول (حمض أو قاعدة) التى يُراد معرفه تركيزه.
- الدليل المناسب هو الدليل الذي يجب أن يتغير لونه عند حدوث التغير المفاجئ في قيمة الأس الهيدروجينى للمحلول حول نقطة التكافؤ.
- أو هو الدليل الذي يتفق مداه و المدى الذي يحدث عنده التغير المفاجئ في قيمة الآس الهيدروجيني للمحلول حول نقطة التكافؤ.
- فيما يلي قائمة لأشهر الأدلة المستخدمة فى معايرة الأحماض والقواعد
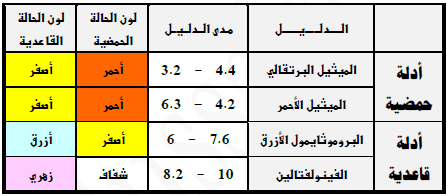

- يُحدد تغير لون الدليل انتهاء المعايرة وذلك عند الوصول إلى نقطة التكافؤ.
- عند معايرة حمض قوى (حمض الكبريتيك ) مع قاعدة قوية (هيدروكسيد البوتاسيوم) فإنه عند نقطة التكافؤ يكون المحلول متــعادلاً لأن كلا من الأيونات الموجودة في محلول الملح لا تتميأ.
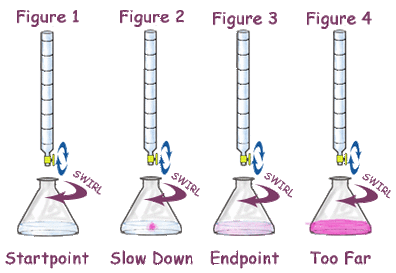
الفرق بين نقطة التكافؤ ونقطة النهاية
- يقصد بنقطة النهاية هي النقطة التي عندها يتغير لون الدليل بشكل دائم ويقاس عندها حجم المحلول المضاف.
- نقطة التكافؤ هى النقطة التى ينتهي فيها التفاعل الكيميائي في خليط المعايرة أو النقطة التي تتساوى عندها مكافئات الحمض مع مكافئات القاعدة في حالة معايرة حمض – قاعدة وهي قيمة نظرية لا يمكن معرفتها أثناء التجربة.
- نقطة التكافؤ تأتي دائمًا قبل نقطة نهاية المعايرة.
- فى المرحلة الثانوية العامة يتم اعتبار نقطة التكافؤ هي نقطة النهاية.
حل المسألة
أولاً/ حساب الحجم عند نقطة النهاية
- نقطة النهاية هي النقطة التي عندها يتغير لون الدليل بشكل دائم ويقاس عندها حجم المحلول المضاف.
- وهى النقطة التى تحول فيها دليل الفينولفثالين من عديم اللون إلى اللون الوردى (الزهري) وهي النقطة التى يكون عندها اللون ثابت لا تغير.
- لذا فأن حجم القاعدة المضاف عند نقطة النهاية = 37 مل وهى النقطة التى يحدث عندها أول تغير للون الدليل بشكل دائم.
ثانياً/ حساب تركيز حمض الكبريتيك
- يستخدم القانون التالي فى حسابات معايرة الأحماض والقواعد
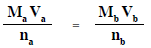
Ma = تركيز الحمض المستخدم (mol/L)
Va = حجم الحمض المستخدم فى المعايرة (ml)
na = عدد المولات من الحمض فى معادلة التفاعل المتزنة
Mb = تركيز القاعدة المستخدم (mol/L)
Vb = حجم القاعدة المستخدم فى المعايرة (ml)
nb = عدد المولات من القاعدة فى معادلة التفاعل المتزنة
H2SO4 + 2KOH → K2SO4 + 2H2O
حمض الكبريتيك يكون:
Ma = ?? M
Va = 100 ml
na = 1
قاعدة هيدروكسيدالبوتاسيوم يكون:
Mb = 0.6 M
Vb = 37 ml
nb = 2
وبالتعويض فى المعادلة أعلاه يكون:
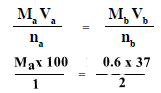
Ma = 0.11 M
تركيز حمض الكبريتيك هو 0.11 مولار (مول/لتر).